
取消
清空記錄
歷史記錄
清空記錄
歷史記錄



【藥輔法規】8月份相關法規匯總(下)-艾偉拓(上海)醫藥科技有限公司
【藥輔法規】8月份相關法規匯總(下)
本期艾偉拓小編給小伙伴們推送8月份藥用輔料相關法規發布情況,內容包括關于中鏈甘油三酸酯guo家藥用輔料標準草案的公示(第二次)、關于《中國藥典》2020年版四部通則增修訂內容(第十九批)的公示等文件,跟著小編一起來看一下吧!
來源:藥典委
1、關于《動物來源藥用輔料指導原則》草案的公示(第二次)
發布日期:8月6日
網址:http://www.chp.org.cn/view/ff8080816c2d76c5016c661c77e96c0c?a=BZFULIAO

我委擬制定《動物來源藥用輔料指導原則》(原名《動物來源藥用輔料生產和質量控制指導原則》),并收載于《中國藥典》四部。為確保指導原則的科學性、合理性和適用性,現第二次公示征求社會各界意見(詳見附件)。公示期為一個月。
2、關于中鏈甘油三酸酯guo家藥用輔料標準草案的公示(第二次)
發布日期:8月9日
網址:http://www.chp.org.cn/view/ff8080816c69cb52016c751d5eb416b9?a=BZFULIAO
我委擬制定中鏈甘油三酸酯guo家藥用輔料標準,為確保標準的科學性、合理性和適用性,現第二次公示征求社會各界意見。公示期為一個月。請相關單位認真研核,若有異議,請及時來函提交反饋意見,并附相關說明、 實驗數據和聯系方式。
3、關于《中國藥典》2020年版四部通則增修訂內容(第十九批)的公示
發布日期:8月9日
網址:http://www.chp.org.cn/view/ff8080816c69cb52016c75c303e417c0?a=BZFL
各有關單位:
按照《中國藥典》2020年版編制工作進度安排,四部通則修訂草案已于2018年2月起分批次在我委網站面向社會各界公開征求意見。根據**、二、三次征求意見稿的反饋意見和建議,我委組織召開相關專業**會進行研討,并整理形成了第二、三、四次征求意見稿(第十九批)。第二、三、四次征求意見稿修改的內容分別以淺橙色、淺藍色、灰色底紋標記(詳見附件1)。
4、關于羥丙基倍他環糊精、甘油、甘油(供注射用)guo家藥用輔料標準修訂草案的公示(第二次)
發布日期:8月15日
網址:http://www.chp.org.cn/view/ff8080816c69cb52016c94416a09500d?a=BZFULIAO
我委擬修訂羥丙基倍他環糊精、甘油、甘油(供注射用)guo家藥用輔料標準,為確保標準的科學性、合理性和適用性, 現第二次公示征求社會各界意見。公示期為一個月。請相關單位認真研核,若有異議,請及時來函提交反饋意見,并附相關說明、實驗數據和聯系方式。
5、關于《9601 藥用輔料功能性相關指標指導原則 》修訂草案的公示
發布日期:8月26日
網址:http://www.chp.org.cn/view/ff8080816c69cb52016ccb8d194f3834?a=BZFULIAO
我委擬修訂《中國藥典》四部指導原則9601(現更名為:藥用輔料功能性相關指標指導原則)。為確保指導原則的科學性、合理性和適用性,現公示征求社會各界意見(詳見附件)。公示期為三個月。請相關單位認真研核,若有異議,請及時來函提交反饋意見,并附相關說明和聯系方式。
NMPA
1、**貫徹落實“四個*嚴”有效保障公眾用藥安全新修訂《藥品管理法》審議通過
發布日期:8月26日
網址:http://www.nmpa.gov.cn/WS04/CL2056/357685.html
2019年8月26日,第十三屆全國人大**會第十二次會議在北京閉幕,會議表決通過《中華人民***藥品管理法》修訂案。新修訂《藥品管理法》將于2019年12月1日施行。這是《藥品管理法》自1984年頒布以來的第二次系統性、結構性的重大修改,將藥品領域**成果和行之有效的做法上升為法律,為公眾健康提供更有力的法治保障。
藥典委
1、關于《中國藥典》四部藥用輔料標準中無菌檢查項調整的公示
發布日期:7月31日
網址:http://www.chp.org.cn/view/ff8080816c2d76c5016c479d66c333b9?a=BZFULIAO
為落實企業主體責任,進一步明確藥用輔料無菌檢查項應基于并滿足所用制劑的要求,2020年版《中國藥典》四部藥用輔料標準中擬不再列入無菌檢查項,在強制執行的通則“0251 藥用輔料”中作統一規定:微生物限度、熱原、細菌內**、無菌等應滿足所用制劑的要求。
2、關于《預混與共處理藥用輔料質量控制指導原則》草案的公示
發布日期:7月26日
網址:http://www.chp.org.cn/view/ff8080816c2cb853016c2d1b70150172?a=BZFULIAO
我委擬制定《預混與共處理藥用輔料質量控制指導原則》,并收載于《中國藥典》四部。為確保指導原則的科學性、合理性和適用性,現公示征求社會各界意見(詳見附件)。公示期為三個月。請相關單位認真研核,若有異議,請及時來函提交反饋意見,并附相關說明、實驗數據和聯系方式。
3、關于《中國藥典》2020年版四部通則增修訂內容(第十七批)的公示
發布日期:8月5日
網址:http://www.chp.org.cn/view/ff8080816c2d76c5016c60089a5e60d3?a=BZFL
各相關單位:
按照《中國藥典》2020年版編制工作進度安排,四部通則修訂草案征求意見稿已于2018年2月起分批次在我委網站面向社會各界公開征求意見。根據征求意見稿的反饋意見和建議,我委組織召開相關專業**會進行研討,并整理形成了第二、第三次征求意見稿(第十七批)。
CDE
1、關于在審化學仿制藥參比制劑有關事宜的通知
發布日期:8月5日
網址:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314914
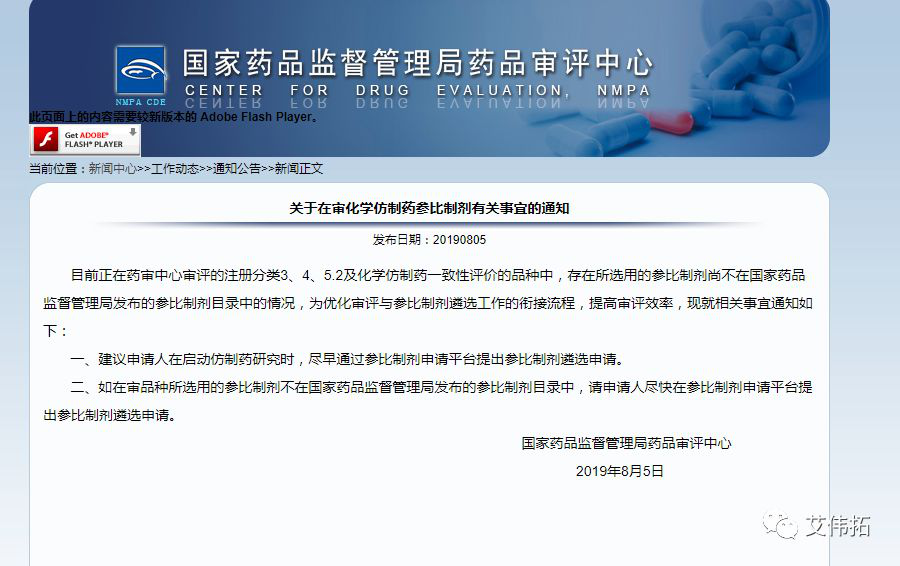
目前正在藥審中心審評的注冊分類3、4、5.2及化學仿制藥一致性評價的品種中,存在所選用的參比制劑尚不在guo家藥品監督管理局發布的參比制劑目錄中的情況,為優化審評與參比制劑遴選工作的銜接流程,提高審評效率,現就相關事宜通知如下。
2、關于公開征求3個ICH Q系列指導原則及其問答文件中文翻譯稿意見的通知
發布日期:8月2日
網址:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314910
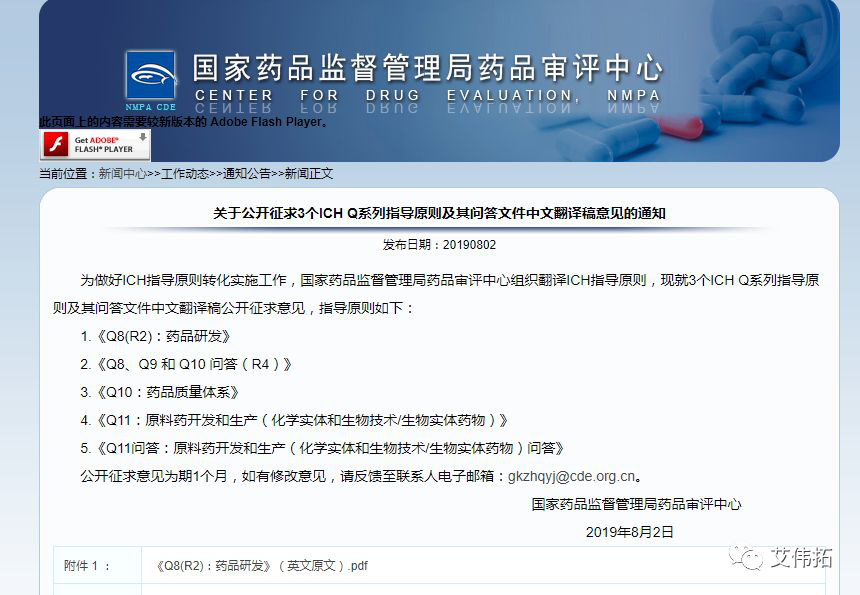
為做好ICH指導原則轉化實施工作,guo家藥品監督管理局藥品審評中心組織翻譯ICH指導原則,現就3個ICH Q系列指導原則及其問答文件中文翻譯稿公開征求意見,指導原則如下。




 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~




